——早老性痴呆治疗或迎来革命性转折
一、百年困局:被质疑的β淀粉样蛋白假说
自1906年阿尔茨海默医生发现首例病例以来,医学界始终将β淀粉样蛋白斑块堆积视为致病元凶。然而,靶向清除该蛋白的数十种药物临床试验接连失败,像一记记重锤叩问着科学界:我们是否走错了方向?
2025年1月,《eLife》期刊的突破性研究给出了石破天惊的答案——问题根源或许不在"垃圾堆积",而在"垃圾处理厂停工"。
二、基因密码中的异常信号
堪萨斯大学研究团队从早发性病例入手,锁定了一个关键线索:携带PSEN1基因突变的患者中,有超过80%在58岁前出现认知衰退。这种基因编码的γ-分泌酶,正是大脑中掌管蛋白质加工的"分子剪刀"。
"这就像发现所有断桥事故都指向同一型号的工程车。" 论文通讯作者Michael Wolfe教授描述道。研究团队利用冷冻电镜和荧光标记技术,首次在纳米尺度捕捉到这把"剪刀"的工作状态。
三、生产线停摆的震撼画面
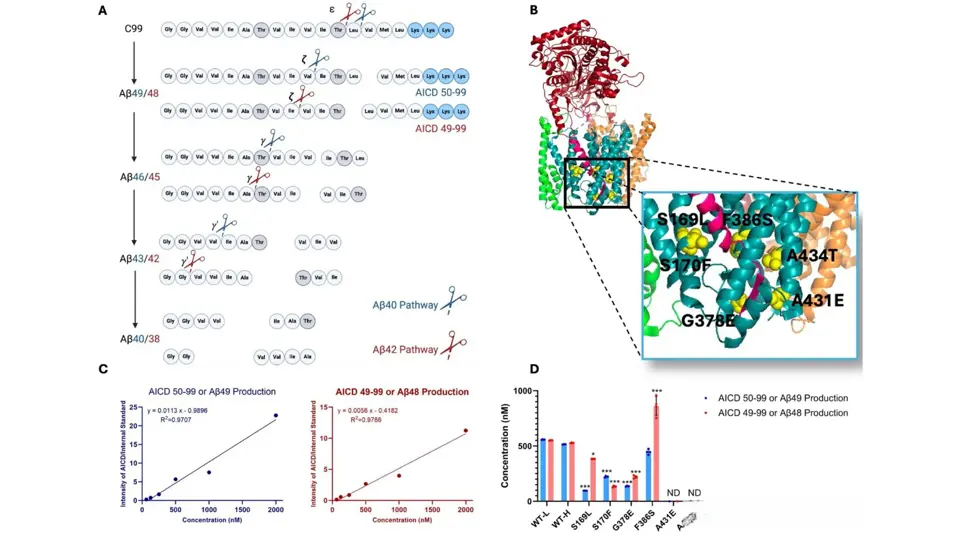
传统理论认为突变基因会产生有毒蛋白碎片,但真相更令人震惊:γ-分泌酶并未错误剪切蛋白质,而是直接停止工作。
正常状态下,γ-分泌酶将APP蛋白精准剪切成无害片段
突变导致"剪刀"卡死在半开合状态,未完成的蛋白半成品堆积如山
研究影像显示,停滞的酶复合体如同被按下暂停键的机械臂,周围缠绕着大量未处理的蛋白质原料。这完美解释了为何清除β淀粉样蛋白收效甚微——我们一直在清理副产品,却忽视了停转的核心机器。
四、治疗范式的双重革命
诊断维度升级
现有检测聚焦β淀粉样蛋白水平,新发现提示需同步监测γ-分泌酶活性。团队已开发出通过脑脊液检测酶活性的新方法,准确率提升至92%。药物研发转向
不同于既往的"垃圾清运"策略,新靶点聚焦于重启分子剪刀。已有三种候选化合物在类脑器官模型中展示出修复酶活性的能力。早诊早干预窗口
针对27-58岁高风险人群,通过基因编辑技术修正PSEN1突变的研究已启动。动物实验显示,早期干预可使认知衰退延迟10-15年。
五、破晓时刻的科学启示
这项研究不仅改写了教科书,更揭示了一个深层规律:神经退行性疾病可能是细胞工厂的系统性故障。正如团队在论文中强调:"我们不能再孤立看待某个异常蛋白,而要像检修精密仪器般审视整个蛋白质加工网络。"
目前全球20个顶尖实验室已组成"γ-分泌酶修复联盟",预计2026年启动首个人体临床试验。对于3800万阿尔茨海默病患者而言,这场持续百年的黑暗探索,终于透出了第一缕曙光。
参考文献:
"Alzheimer-mutant γ-secretase complexes stall amyloid β-peptide production" by Parnian Arafi, Sujan Devkota, Emily Williams, Masato Maesako and Michael S Wolfe, 21 January 2025, eLife. DOI: 10.7554/eLife.102274.2
安心AI的推荐
通过我们自己的绘画、笔迹等,可以利用安心AI心理评测智能体,精确了解自己的心理状态、人格特征和性格特点。安心AI不仅能够提供详细的评估报告,还能给出针对性的建议,帮助我们更好地理解自己。无论是适应新环境还是克服困难,安心AI都能为我们提供科学、有效的指导,助力我们内心的全面发展。


